Der Zeit den entscheidenden Schritt voraus: Was mRNA-Impfstoffe möglich machte
Die mRNA-Technologie birgt enormes Potenzial nicht nur für die Impfstoffentwicklung und hat ihren Wegbereitern in diesem Jahr zum Nobelpreis für Physiologie oder Medizin verholfen. Erfahren Sie in unserem Artikel, wie diese Technologie die enorm schnelle Entwicklung der COVID-19-Impfstoffe überhaupt ermöglichte und welche klinischen Anwendungen darüber hinaus auch künftig von ihr zu erwarten sind.
Die Entwicklung von Impfstoffen ist immer auch ein Wettlauf mit der Zeit. Im Besonderen galt dies, als Ende 2019 SARS-CoV-2 auftrat und sich rasch in alle Teile der Welt ausbreitete. Nur wenige dachten wohl, dass der rasanten und in einigen Ländern verheerenden Entwicklung der Coronavirus-Pandemie schnell hoch-wirksame Impfstoffe entgegengesetzt werden könnten. Doch tatsächlich ist genau dies gelungen: Mehrere Vakzine wurden in Rekordzeit auf den Markt gebracht und retteten unzählige Menschenleben.
Zwei der am schnellsten zugelassenen und wirksamsten Impfstoffe basieren auf der sogenannten mRNA-Technologie. Die Idee dazu entstand schon vor über 30 Jahren, doch zunächst verhinderten entscheidende Hürden ihre klinische Anwendung. Erst die Arbeit von Katalin Karikó und Drew Weissman brachte den Durchbruch – und den beiden Forschern nun den Nobelpreis für Physiologie oder Medizin 2023. Denn ihren Forschungsergebnissen ist es maßgeblich zu verdanken, dass die sogenannte mRNA-Impfstoffplattform zu einem Zeitpunkt für den klinischen Einsatz bereitstand, zu dem sie überaus dringend benötigt wurde – und auch der Weg für zukünftige mRNA-Anwendungen geebnet war. Doch was genau hatten Karikó und Weissman herausgefunden? Um das zu erklären, ist ein kurzer Blick auf Theorie und Historie der Impfstoffentwicklung hilfreich.
Das Prinzip Impfung und Impfstoffe vor der Pandemie
Eine Impfung stimuliert die Bildung einer Immunreaktion gegen einen bestimmten Krankheitserreger. Zunächst erfolgt eine spezifische und schnelle Immunreaktion auf das entsprechende Antigen des Erregers, nachfolgend bilden sich sogenannte Gedächtniszellen. Sie sind bei einem erneuten Kontakt mit diesem Erreger ausschlaggebend dafür, dass das Immunsystem bereits vorbereitet ist, das heißt eine Immunität gegen den Erreger aufgebaut hat: Es kann sofort die passenden Antikörper bilden, die wiederum in einer spezifischen Immunreaktion die Infektion bekämpfen. Das ausgehende 19. und insbesondere das 20. Jahrhundert waren – bedingt durch Erfahrungen aus der ersten Pockenimpfung und die Entdeckung von Bakterien und Viren als Krankheitserreger – das Zeitalter der gezielten Impfstoffentwicklung. Louis Pasteur fand 1881 einen Impfstoff gegen den Milzbrand und 1913 entwickelte Emil von Behring einen Impfstoff gegen die Diphtherie. Es folgten Impfstoffe gegen Tetanus und Pertussis (Keuchhusten) (1926), gegen Gelbfieber und Influenza (Grippe) (1936) und gegen Poliomyelitis (Kinderlähmung) (1955 bzw. 1961). In den 1960er Jahren wurden dann in Deutschland die Impfstoffe gegen Masern, Mumps und Röteln verfügbar. Neben der Entdeckung von Antibiotika gehört diese Impfstoffentwicklung auf der Basis abgetöteter Krankheitserreger zu den für die Menschheit wohl bedeutendsten Meilensteinen der Medizingeschichte und rettete unzählbar viele Menschen vor Tod oder Entstellung. Im Jahr 1951 erhielt Max Theiler den Nobelpreis für Physiologie und Medizin für die Entwicklung des Gelbfieberimpfstoffs.
https://www.nobelprize.org/prizes/medicine/2023/press-release/
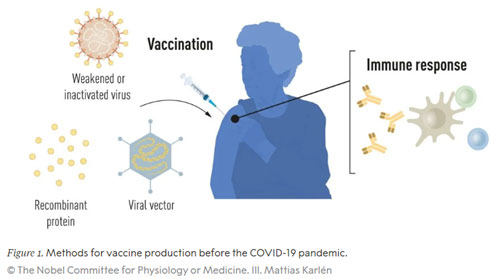
Die meisten der heute zugelassenen antiviralen Impfstoffe werden nach wie vor im herkömmlichen Verfahren auf der Grundlage abgeschwächter oder inaktivierter Vollviren hergestellt. Doch ihre Herstellung ist ressourcen- und zeitintensiv: Da Viren sich nicht selbstständig replizieren können, sondern auf die DNA/RNA-Synthese-Maschinerie von Wirtszellen angewiesen sind, erfolgt die Impfstoff-Produktion klassischerweise und zeitaufwändig in Hühnereiern oder aber Zellkulturen. Eine schnelle Reaktion auf Ausbrüche und Pandemien ist auf diese Weise kaum möglich.
Mit den Fortschritten in der Molekularbiologie und der Entwicklung von Technologien zur Herstellung rekombinanter Proteine ergaben sich neue Möglichkeiten für gezieltere Impfstoffansätze, die nicht mehr auf ganzen Viruspartikeln (Virionen) basieren, sondern nur auf denjenigen antigenen Teilen, auf die das Immunsystem reagiert. Der erste Impfstoff, der auf diese Weise hergestellt wurde, war der 1986 zugelassene Hepatitis-B (HBV)-Impfstoff, dem 2006 die Zulassung des ersten Impfstoffs gegen (krebsauslösende) humane Papillomviren (HPV) folgte. Die HBV- und HPV-Impfstoffe enthalten einzelne Proteinkomponenten des jeweiligen Virus und werden als Subunit-Impfstoffe bezeichnet. Doch auch diese Impfstoffe erfordern in der Herstellung den Einsatz von Zellkulturen – mit den entsprechenden Einschränkungen durch diesen ressourcenintensiven Prozess. Daher haben Forscher lange versucht, Impfstofftechnologien unabhängig von Zellkulturen zu entwickeln, und in der mRNA-Technologie eine vielversprechende Option gefunden.
mRNA-Impfstoffe: Idee mit weitreichendem Potenzial
In unseren Zellen wird die in der DNA kodierte Erbinformation auf die Boten-RNA (mRNA) übertragen, die als Vorlage für die Proteinbiosynthese dient. In den 1980er Jahren wurden effiziente Methoden zur Herstellung von mRNA ohne Zellkultur eingeführt, die sogenannte in vitro-Transkription. Dieser entscheidende Schritt beschleunigte die Entwicklung molekularbiologischer Anwendungen in verschiedenen Bereichen. Die Idee, die neuen molekularbiologischen Techniken zur Herstellung von Impfstoffen auf mRNA-Basis zu verwenden oder Krankheiten durch die Verabreichung von mRNA zu behandeln, indem man defekte Gene durch funktionelle ersetzt beziehungsweise ein therapeutisches Protein überexprimiert, weckte großes Interesse. Doch es gab entscheidende Hindernisse. In vitro-transkribierte mRNA galt als instabil, schwierig in der Verabreichung und führte im Körper zu Entzündungsreaktionen, was die Entwicklung von ausgeklügelten Trägerlipidsystemen zur Verkapselung der mRNA notwendig machte. Der Enthusiasmus für die Entwicklung der mRNA-Technologie für klinische Zwecke hielt sich daher zunächst in Grenzen. Die ungarische Biochemikerin Katalin Karikó und ihren Kollegen, den Immunologen Drew Weissman, entmutigte dies jedoch nicht, an ihrer Idee der Entwicklung von Methoden zur Nutzung von mRNA für klinische Anwendungen festzuhalten. Beide forschten in den frühen 1990er Jahren an der Universität von Pennsylvania und eine fruchtbare Zusammenarbeit begann.
Wie Karikó und Weissman der Durchbruch gelang
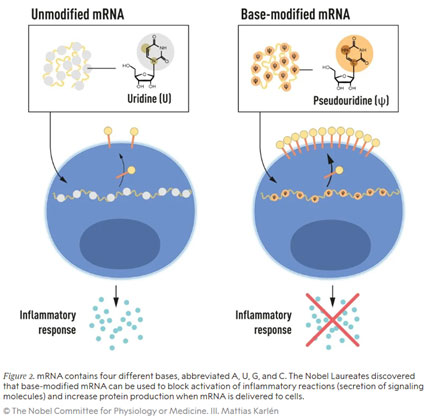
Karikó und Weissman konnten zeigen, dass dendritische Zellen – hochspezialisierte antigenpräsentierende Zellen des Immunsystems, die antigenspezifische Immunantworten initiieren und regulieren – die verabreichte in vitro-transkribierte mRNA als Fremdsubstanz erkennen, was zur Zellaktivierung und der Freisetzung von Entzündungssignalen führt. Sie fragten sich, warum nur in vitro-transkribierte mRNA diese Reaktion auslöste, in Säugetierzellen hergestellte mRNA jedoch nicht. Bekannt war bereits, dass die Nukleosidbasen der RNA aus Säugetierzellen häufig chemisch modifiziert sind, diejenigen der mRNA aus in vitro-Transkriptionen hingegen nicht. Konnte das Fehlen dieser posttranskriptionellen Basen-Modifikationen ursächlich sein für die unerwünschte Entzündungsreaktion auf in vitro hergestellte mRNA? Um dies zu untersuchen, produzierten Karikó und Weissman in vitro verschiedene mRNA-Varianten mit jeweils einer definierten chemischen Veränderung in den Basen und applizierten sie dendritischen Zellen. Die Ergebnisse waren verblüffend: Die Entzündungsreaktion wurde nahezu aufgehoben, wenn 5-Methylcytidin (m5C), N6-Methyladenosin (m6A), Pseudouridin (ψ), 5-Methyluridin (m5U) oder 2-Thiouridin (s2U) in die in vitro-transkribierte mRNA eingebaut wurde.
https://www.nobelprize.org/prizes/medicine/2023/press-release/
Dies war nicht nur ein Paradigmenwechsel für das Verständnis, wie Zellen verschiedene Formen von mRNA erkennen und darauf reagieren, Karikó und Weissman erkannten auch sofort, dass ihre Entdeckung tiefgreifende Bedeutung für die Verwendung von mRNA in der Therapie hatte. Ihre bahnbrechenden Ergebnisse wurden im Jahr 2005 veröffentlicht, fünfzehn Jahre vor der COVID-19-Pandemie. In weiteren Studien, die 2008 und 2010 veröffentlicht wurden, zeigten die beiden Forscher, dass in vitro-transkribierte, nukleosidbasisch-modifizierte mRNA im Vergleich zu unmodifizierter mRNA auch die Proteinproduktion deutlich steigerte – ein weiter wichtiger Baustein für die Verwendung in medizinischen Therapien. Damit waren die beiden entscheidenden Steine aus dem Weg geräumt, die die Prüfung einer klinischen Anwendung von mRNA bis dahin verhindert hatten.
mRNA-Technologie: Lebensretter in der Pandemie, vielversprechend für die Zukunft
Bis heute haben Forscher mehr als hundert verschiedene posttranskriptionelle Modifikationen in der RNA aufgedeckt. Spätere Arbeiten zeigten, dass die Verwendung von N1-Methylpseudo-Uridin (m1ψ), allein oder in Kombination mit dem oben beschriebenen Methylcytidin m5C, die mRNA-Plattform weiter verbesserte, und zwar sowohl in Bezug auf die Verringerung der Erkennung angeborener Immunrezeptoren als auch in Bezug auf die Steigerung der Proteinexpression.
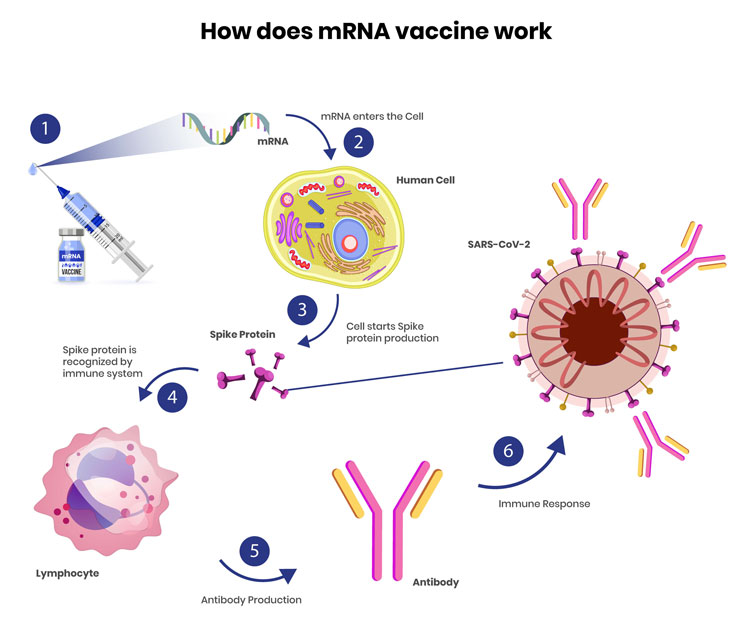
Das Interesse an der mRNA-Technologie begann zu wachsen und brachte bis 2010 insbesondere drei große Player – CureVac, BioNTech und Moderna – an den Markt, die an der Weiterentwicklung und therapeutischen Anwendungen dieser Methode arbeiteten und unter anderem Impfstoffe gegen das Zika-Virus und MERS-CoV entwickelten, einem SARS-CoV-2 eng verwandten Virus. Nach dem Ausbruch der COVID-19 Pandemie waren diese Unternehmen in der Lage, schnell zu reagieren, und entwickelten unter Verwendung von m1ψ in Rekordzeit zwei nukleosidbasisch-modifizierte mRNA-Impfstoffe, die für das SARS-CoV-2 Oberflächenprotein kodierten. In den klinischen Studien wurde eine Immunschutz-Wirkung von etwa 95 % berichtet und beide Impfstoffe wurden bereits im Dezember 2020 zugelassen.
Bis dato wurden weltweit rund 15 Milliarden COVID-19-Impfdosen verabreicht und das Vakzin wird fortlaufend an die aktuellen Sars-CoV-Varianten angepasst. Eine Entwicklung während einer der größten Gesundheitskrisen unserer Zeit, die ohne die Arbeit der diesjährigen Nobelpreisträger für Physiologie oder Medizin nicht möglich gewesen wäre. Die beeindruckende Flexibilität und Geschwindigkeit, mit der neue mRNA-Impfstoffe entwickelt werden können, ebnen dabei auch den Weg für die künftige Nutzung der neuen Plattform auch für Impfstoffe gegen andere Infektionskrankheiten. Viele Experten gehen davon aus, dass die mRNA-Technologie in etwa 20 Jahren das dominierende Impfprinzip sein wird. Zudem könnte die Technologie künftig auch zum Aufbau therapeutischer Proteine in Patienten und zur Behandlung einiger Krebsarten eingesetzt werden. In einer ad hoc-Meldung berichtete BioNTech kürzlich, die Wirkung einer Impfung gegen Krebs erstmals an Menschen nachgewiesen zu haben. Die dahinterstehende Idee ist dabei, das Immunsystem zu lehren, Krebszellen als fremd zu erkennen, obwohl sie körpereigen sind. Auch Tumorzellen bilden Antigene, die das Immunsystem triggern könnten – allerdings wissen sich Tumorzellen gut vor der körpereigenen Immunabwehr zu verbergen. Die Grundlage der nun präsentierten Impfung ist eine Kombination aus sogenannten CAR-T-Zellen und einem mRNA-Impfstoff, wobei CAR-T für „chimärer Antigenrezeptor-T“(-Zellen) steht. Es handelt sich dabei um künstlich veränderte Immunzellen, die aus patienteneigenen Zellen erzeugt werden. Sie produzieren ein bestimmtes Protein (chimärer Antigenrezeptor) und präsentieren es auf ihrer Oberfläche. Diese „Antenne“ sorgt dafür, dass die CAR-T-Zellen die Krebszellen des Patienten erkennen, nach dem Schlüssel-Schloss-Prinzip zielgenau daran binden und sie zerstören können. Eine für einige Krebsarten vielversprechende, aber teure und zeitaufwändige Strategie. Die BioNTech-Arbeiten zeigen, dass der mRNA-Impfstoff die Immunzellen dazu befähigen kann, den chimären Antigenrezeptor selbst zu erzeugen, was die zeit- und kostenaufwändige Modifikation dieser Zellen im Labor schnell und elegant ersetzt. Die Kombination aus CART-Zellen und mRNA legt damit die Grundlage dafür, dass die entsprechenden Krebszellen im Körper sofort nach ihrer Entstehung eliminiert werden können.
Die Entwicklung, die die Nobelpreisträger Karikó und Weissman auf den Weg gebracht haben, ist also noch lange nicht an ihrem Ende. In unserer globalisierten Welt ist das Auftreten erneuter Pandemien nicht unwahrscheinlich und auch Krebs gehört seit jeher zu den großen Geißeln der Menschheit. Karikó und Weissman haben uns ein wertvolles Werkzeug an die Hand gegeben, um nicht schutzlos ausgeliefert zu sein.
Quellen:
https://www.nobelprize.org/prizes/medicine/2023/summary/
https://www.nobelprize.org/prizes/medicine/2023/press-release/
https://www.nobelprize.org/uploads/2023/10/press-medicineprize2023-3.pdf
https://www.nobelprize.org/prizes/medicine/2023/advanced-information/
https://www.wienerzeitung.at/a/eine-impfung-gegen-krebs?utm_source=pocket-newtab-de-de
https://www.impfen.de/impfwissen/alle/die-geschichte-der-impfung/



