Nobelpreis für Physiologie/Medizin 2025
Immuntoleranz oder das Bremspedal des Immunsystems
Unsere Körperabwehr ist überlebenswichtig. Angesichts der Fülle an potenziell krankmachenden Keimen, die uns täglich – nicht nur im Winter – umgeben, sind schwere Infektionen genau genommen eine Seltenheit. Unser (intaktes) Immunsystem schützt uns als effiziente „Gesundheitspolizei“ vor krankmachenden Mikroorganismen, aber auch vor entarteten (Krebs-) Zellen. Es ist ein komplexes Zusammenspiel unterschiedlicher Immunzellen des angeborenen und des erworbenen Immunsystems, das diesen Schutz vermittelt. Fremde oder entartete Zellen werden von ihnen erkannt und eliminiert und zusätzlich wird ein Antikörper-basierter Immunschutz aufgebaut.
Doch so effizient und überlebensnotwendig diese zelluläre Gesundheitspolizei ist – wie so oft im Leben ist Mäßigung ebenso zwingend: Jedes Immunsystem sollte tunlichst in der Balance gehalten werden. Es muss zuverlässig in der Lage sein, zwischen Freund und Feind, also zwischen körpereigen und fremd, zu unterscheiden, und sich nach erfolgreichem Einsatz zügig wieder herunterregulieren. Wehe, wenn dem nicht so ist, denn ein aus dem Gleichgewicht geratenes Immunsystem ist eine ernsthafte Bedrohung für unseren Körper: Gefährliche, überschießende Immunreaktionen können sich bis zum lebensbedrohlichen Schock hochschaukeln, bei Autoimmunerkrankungen greifen Immunzellen körpereigene Strukturen an und zerstören diese. Unsere Abwehrkräfte in Schach zu halten, ist somit essenziel und die anspruchsvolle Aufgabe einer weiteren zellulären Garde, für deren Entdeckung und Charakterisierung Shimon Sakaguchi, Mary E. Brunkow und Fred Ramsdell Ende 2025 den Nobelpreis für Physiologie oder Medizin erhielten. Was ist ihnen gelungen?
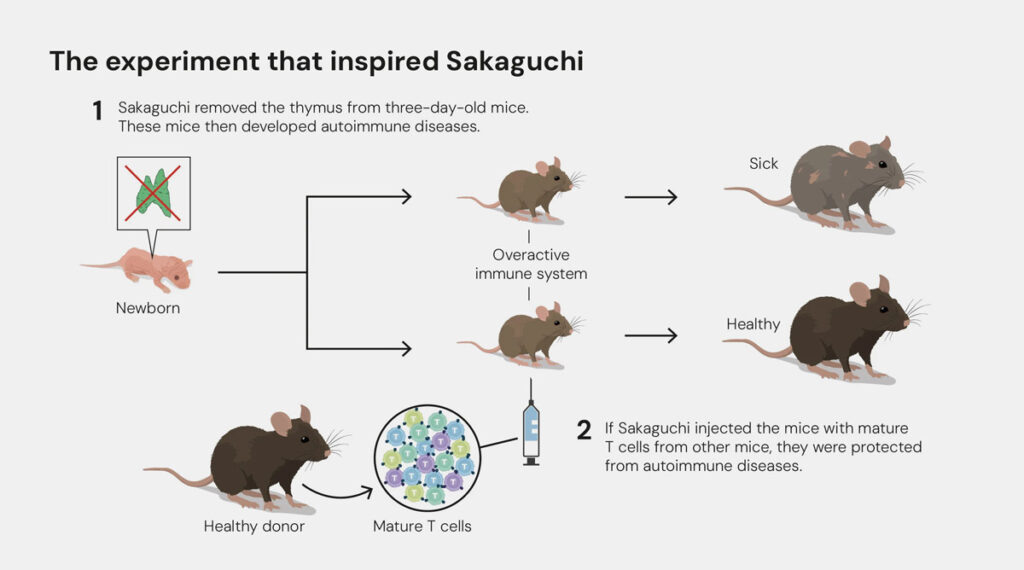
Sakaguchi entdeckte 1995 eine neue Klasse von Immunzellen, die er regulatorische T-Zellen, kurz Treg oder Treg nannte. Genau genommen waren diese Zellen schon seit den 1970er Jahren im Visier der Wissenschaft – damals noch unter dem Namen „Suppressorzellen“. Doch man konnte sie mit den damaligen Methoden nicht zuverlässig von anderen T-Zellen unterscheiden. Genau das gelang Sakaguchi schließlich mit seiner bahnbrechenden Arbeit. Der Schlüssel: verfeinerte Analytik und ein spezieller Oberflächenmarker, den innerhalb der großen Gruppe der T-Lymphozyten nur die Tregs ausbilden. Bei diesem CD25 genannten Marker handelt es sich um die alpha-Kette des Interleukin-2-Rezeptors.
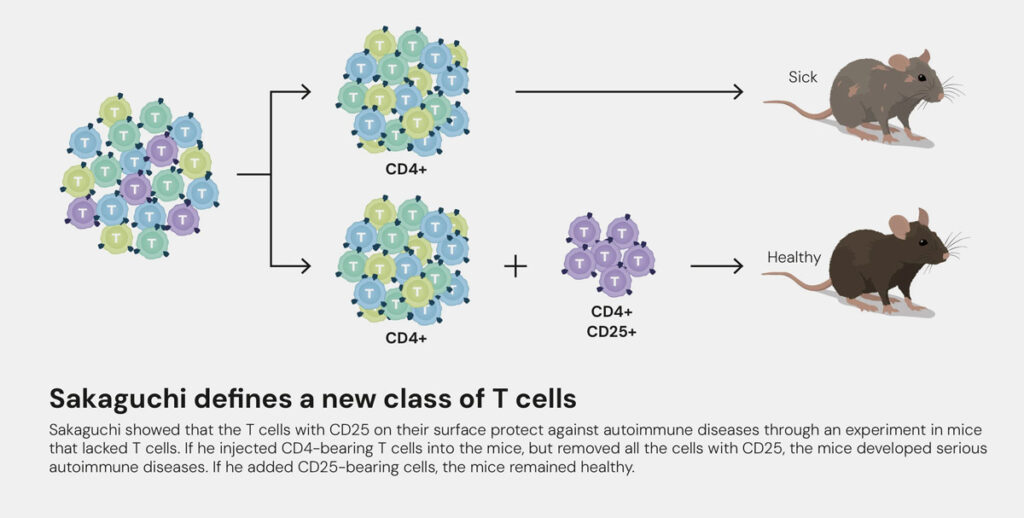
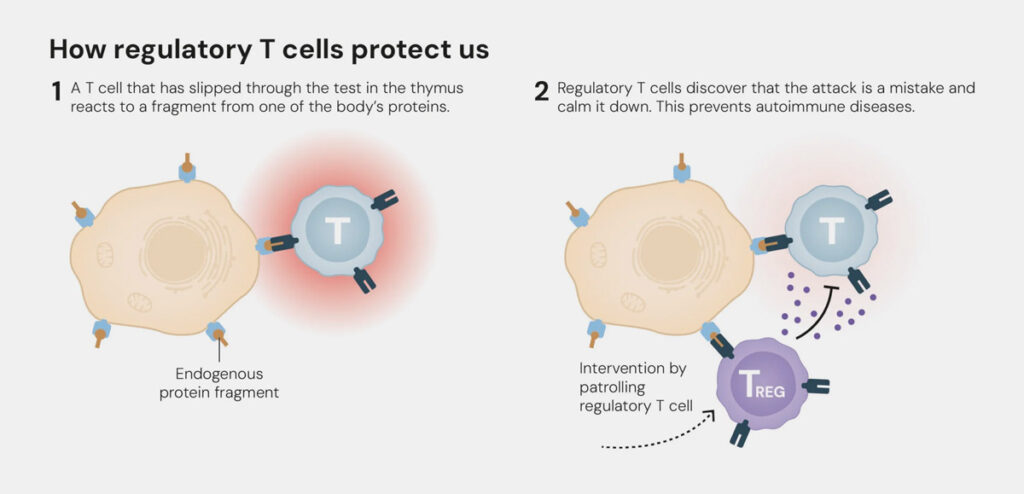
Wie sich herausstellen sollte, verhindern die Tregs als „Wächter des Immunsystems“, dass die Körperabwehr unseren eigenen Organismus attackiert, sie besitzen also immunregulatorische Funktionen. Den so erhaltenen Zustand nennen Forscher Immuntoleranz. Bis zu ihrer Entdeckung durch Sakaguchi war vorherrschende wissenschaftliche Meinung, dass die Immuntoleranz v.a. zentral im Thymus reguliert wird. T-Lymphzyten werden im Knochenmark produziert und reifen im Thymus, wo sie für ihre spätere Aufgabe programmiert werden. Immunzellen, die sich fälschlicherweise gegen körpereigene Strukturen richten, werden dabei „aussortiert“, d.h. in den programmierten Selbstmord, die sogenannte Apoptose, getrieben. Doch jedes System ist fehlbar. Sakaguchi entdeckte in den regulatorischen T-Zellen die notwendige weitere Kontrollinstanz, um überschießende oder gegen körpereigene Strukturen gerichtete Immunreaktionen zu unterdrücken. Und zwar direkt am Ort des Geschehens – in unserem Blut, im lymphatischen System und im Gewebe.
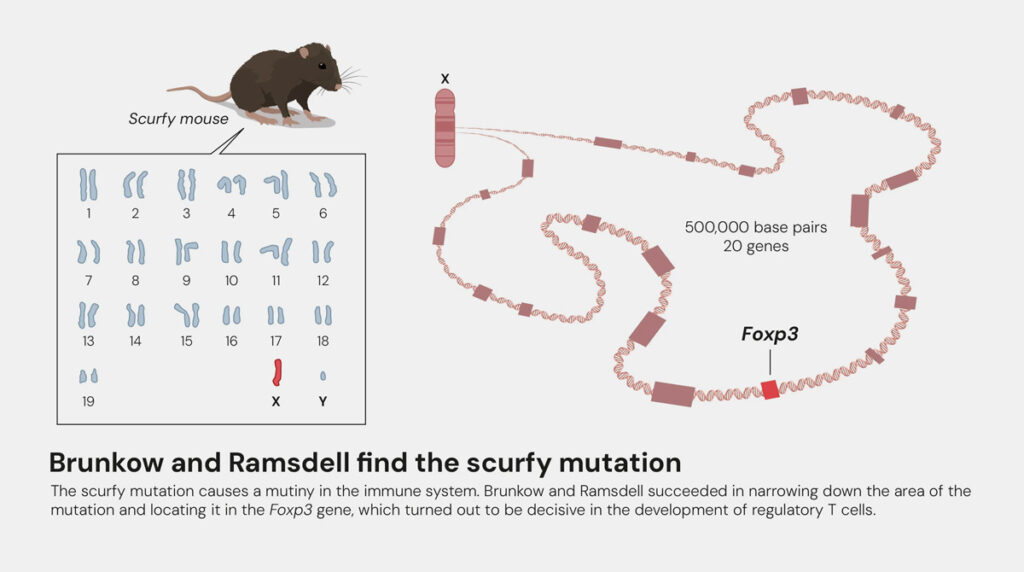
Im Jahr 2001 stießen Mary E. Brunkow und Fred Ramsdell indes auf die genetische Grundlage einer schweren Autoimmunerkrankung: des Immun-Dysregulation-Polyendokrinopathie-Enteropathie-Syndroms (IPEX-Syndrom). Als Ursache identifizierten die Forscher eine Mutation des Gens FOXP3, die auch in ebenfalls autoimmun erkrankten, sogenannten Scurfy-Mäusen zu finden ist.
Zwei Jahre später gelang es wiederum Ramsdell und Sakaguchi, diese beiden Entdeckungen miteinander zu verbinden, indem sie bewiesen, dass das Protein FOXP3 als Transkriptionsfaktor, gewissermaßen als „Ein-/Aus-Schalter“, die Entwicklung der regulatorischen T-Zellen steuert. Damit war die Verbindung zwischen regulatorischen T-Zellen, Autoimmunerkrankungen und FOXP3 hergestellt und das Konzept der Peripheren Immuntoleranz geboren.
„Wir verstehen jetzt besser, wie das Immunsystem funktioniert und warum nicht jeder von uns eine schwere Autoimmunerkrankung entwickelt“, begründet die Nobelversammlung bei der Verkündigung der Preisträger ihre Entscheidung.
Doch wie genau bremsen die Tregs unser Immunsystem, ohne dabei die Abwehrkräfte insgesamt zu schwächen? Und wie lassen sich die fundamentalen Erkenntnisse der diesjährigen Nobelpreisträger erweitern und nutzen?
Wie regulieren regulatorische T-Zellen das Immunsystem – und wer reguliert sie?
Unter anderem bremsen sie die Teilungsaktivität von T-Helferzellen und drosseln gleichzeitig deren Produktion von Immunbotenstoffen, indem sie wichtige Transkriptionsfaktoren in den Helferzellen blockieren. Tregs unterdrücken auf diese Weise Entzündungsprozesse und tragen durch die Freisetzung von Zytokinen selbst aktiv zur Geweberegeneration bei.
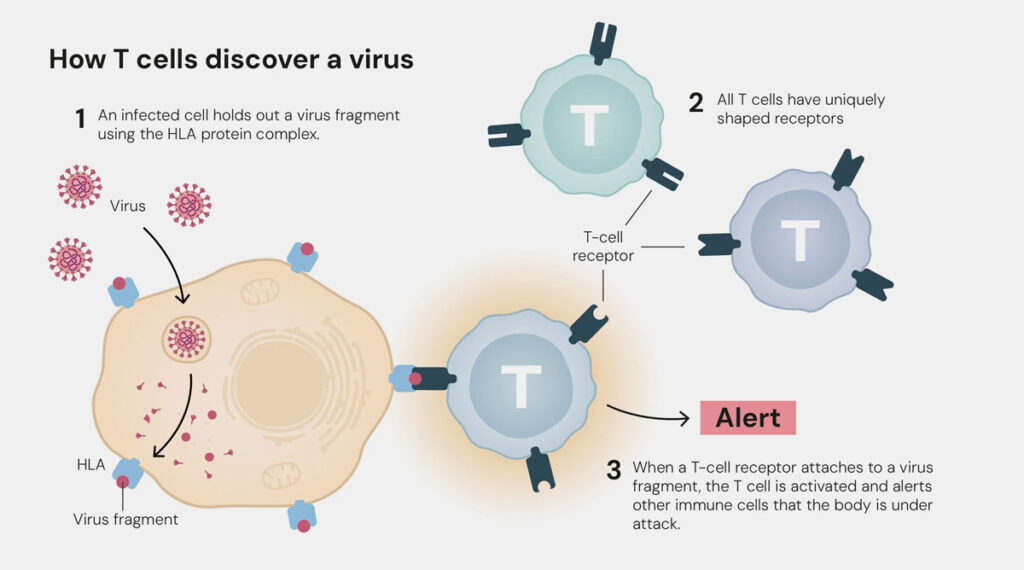
T-Helferzellen werden durch Antigen-Bindung aktiviert (z.B. Virus-Oberflächenproteine) und setzen dann „Zytokine“ frei. Diese Botenstoffe aktvieren Immunzellen (z.B. B-Zellen und zytotoxische T-Zellen) und damit eine spezifische Immunantwort gegen Krankheitserreger und Krebszellen. T-Helferzellen sind ein wichtiger Baustein der erworbenen Immunität und wichtige Akteure bei Infektionen, Autoimmunerkrankungen, Allergien und Krebs.
Wäre diese Bremse des Immunsystems jedoch dauerhaft angezogen, würden unsere Abwehrkräfte geschwächt. Genau diesen Effekt machen sich entartete Zellen in Tumoren zunutze, indem sie regulatorische T-Zellen um sich sammeln und so die heilende Immunreaktion des Körpers gegen die Tumore drosseln. Auch die Regulatoren müssen ihrerseits also reguliert werden.
Die Aktivierung der Tregs erfolgt antigenspezifisch und die Zellen vermehren sich im Vergleich zu normalen T-Zellen schneller, was eine schnelle und hohe Aktivität hervorruft. Ihre Deaktivierung erfolgt zeitnah und automatisch: Tregs sind äußerst instabil, d.h. sie sterben vergleichsweise schnell durch Apoptose.
Enormes Anwendungspotenzial mit einigen Hürden
Die Arbeiten der drei Nobelpreisträger liefern nicht nur fundamentales Grundlagenwissen, Tregs bergen darüber hinaus enormes therapeutisches Potenzial. Als „Wirkstoff“ für die Behandlung von Erkrankungen, die mit einem überaktiven oder fehlgeleiteten Immunsystem einhergehen, könnten sie helfen, Autoimmunerkrankungen, Allergien oder auch Abstoßungsreaktionen nach Organtransplantationen besser zu kontrollieren. Schwächt man die Wirkung der Tregs hingegen ab, löst also die Immunbremse, könnte dies die Behandlung von Krebs unterstützen. Und auch die seit einigen Jahren aufstrebende CAR-T-Zell-Therapie könnte von Tregs profitieren, indem sie diese neue Behandlungsform auf Erkrankungen mit fehlgeleitetem Immunsystem ausweitet, wie bestimmte Leberentzündung oder neurodegenerative Erkrankungen, Diabetes-Typ-1 oder Multiple Sklerose.
Doch ein generelles Problem limitierte noch lange Zeit nach ihrer Entdeckung die Nutzung des therapeutischen Potenzials der Tregs. Denn was im Körper unbedingt erforderlich ist, um das Immunsystem nicht dauerhaft zu schwächen, ist für die weitere Erforschung, Optimierung und klinische Anwendung der Tregs äußerst hinderlich: ihre Instabilität. Dabei sind nicht nur die Gewinnung, Aufreinigung und Expandierung der Zellen in therapeutisch relevanten Mengen Herausforderung, die Tregs neigen auch dazu, unter Laborbedingungen wieder zu „normalen“ T-Zellen zu werden. Zahlreiche klinische Studien an Treg-gestützten Therapien, beispielsweise bei Typ-1-Diabetes, Lupus erithematodes, Rheumatoider Arthritis oder Hashimoto-Thyreoiditis, sind zwar bereits beschrieben, doch über die klinischen Phasen I oder II kamen sie bisher nicht hinaus.
Das könnte sich absehbar ändern: Ausgerechnet die Arbeitsgruppe um den frisch nominierten Nobelpreisträger Sakaguchi hat nun zwei wissenschaftliche Veröffentlichungen publiziert, in denen die Forscher sowohl Protokolle für die stabile Herstellung von Tregs aus Mäusen und Menschen beschreiben [1] als auch ihre Anwendung bei der Autoimmunerkrankung Pemphigus vulgaris . Sakaguchi und sein Team entwickelten dazu ein Protokoll zur pharmakologischen epigenetischen Umprogrammierung von T-Zellen und wandelten auf diese Weise konventionelle (stabile) CD4+-T-Helferzellen zu (ebenfalls stabilen) Tregs um. Bleibt zu hoffen, dass sich diese Ansätze für breite Anwendungsfelder etablieren lassen. Dann könnten die Tregs gewissermaßen mit dem Aufwind des Nobelpreises endlich in die Sphären der klinischen Anwendung aufsteigen und dort ihr gesamtes Potenzial entfalten. Verdient hätten sie es.
Zitierte Quellen:
[1] N. Mikami et al., 2025, Science Translational Medicine DOI: 10.1126/scitranslmed.adr6049
[2] M. Mukai et al., 2025, Science Translational Medicine DOI: 10.1126/scitranslmed.adq9913
Weitere Quellen:
Pressemitteilung: Nobelpreis für Physiologie oder Medizin 2025 – NobelPrize.org
Scientific background to the Nobel Prize in Physiology or Medicine 2025
Immuntoleranz im Fokus: Medizin-Nobelpreis 2025
Medizin-Nobelpreis 2025 für Erforschung der Immunregulation – Spektrum der Wissenschaft
Medizin-Nobelpreis 2025 für Forschung zur Immuntoleranz
Wie regulatorische T-Zellen das Immunsystem kontrollieren
Potente Sensibelchen in der Klinik | PZ – Pharmazeutische Zeitung
239 Regulatorische T-Zellen (Treg) als Basismarker zum Monitoring immunmodulierender Maßnahmen
Selbstkontrolle des Immunsystems dämpft Krebsabwehr – Deutsches Krebsforschungszentrum
Wie regulatorische T-Zellen reguliert werden – MT-Dialog
Klinische Studien:
Medizinische Hochschule Hannover : Bio-Navi gegen fehlgeleitetes Immunsystem
Fehlgeleitete Immunreaktionen: Regulatorische CAR-T-Zellen entwickelt – Biermann Medizin